- Startseite
- News
- AFS
- Anaphylaxie - Update
- Atemwegsmanagement im Notfall
- Benignes Prostatasyndrom
- COVID19
- EH Benneckenstein 2018
- EH Teistungen 2020
- Einsatz: Bombendrohung Duderstadt
- Einsatz: Frühjahrsvolkslauf 2018
- Einsatz: RockHarz 2022
- HWS-Immobilisation
- Hygiene: Hände und Barrieremaßnahmen
- Medizinisches Cannabis
- Mobile Impfteams
- NFT: Zahnarztpraxis Duderstadt 2018
- Notarztdienst Hagenow
- Patientenverfügung
- PNEA
- Presse: Reanimationstraining
- SAN: Teistungen 2018
- Strahlenschutz
- Todesfeststellung und Leichenschau
- Downloads
- Bildergalerie
- Fälle aus der Praxis
- Shop
- Gästebuch
- Wissen online
- Lexikothek
- Über uns
- Kontakt
- Privat
- AFS
- Anaphylaxie - Update
- Atemwegsmanagement im Notfall
- Benignes Prostatasyndrom
- COVID19
- EH Benneckenstein 2018
- EH Teistungen 2020
- Einsatz: Bombendrohung Duderstadt
- Einsatz: Frühjahrsvolkslauf 2018
- Einsatz: RockHarz 2022
- HWS-Immobilisation
- Hygiene: Hände und Barrieremaßnahmen
- Medizinisches Cannabis
- Mobile Impfteams
- NFT: Zahnarztpraxis Duderstadt 2018
- Notarztdienst Hagenow
- Patientenverfügung
- PNEA
- Presse: Reanimationstraining
- SAN: Teistungen 2018
- Strahlenschutz
- Todesfeststellung und Leichenschau
COVID19
verfügbare therapieoptionen
aus: CME.Medlearning.de, 2023
Einleitung
Anfang Januar 2020 wurde ein neuartiges Coronavirus als Erreger einer Erkrankung, welche mit schweren Pneumonien und hoher Morbidität und Mortalität einhergeht, identifiziert. Erstmals führte dies in der chinesischen Miliionenstadt Wuhan zu einem Ausbruch. Für dieses Coronavirus – phylogenetisch mit dem SARS-CoV-1 (Schweres Akutes Respiratorisches Syndrom)-Virus verwandt, welches schon im Jahr 2002 eine Pandemie ausgelöst hatte – wurde im Februar 2020 der Erregernamen SARS-CoV-2 (Schweres Akutes Respiratorisches Syndrom Coronavirus-2) von einem Expertengremium vorgeschlagen. Für die von SARS-CoV-2 ausgelöste Erkrankung, die von Mensch zu Mensch übertragen werden kann, hat die Weltgesundheitsorganisation (WHO) den offiziellen Namen COVID-19 (Coronavirus Disease 2019) festgelegt. COVID-19 wurde am 30. Januar 2020 zu einem internationalen Gesundheitsnotfall (PHEIC) und am 11. März 2020 zu einer Pandemie erklärt.
Coronaviren: SARS-COV-2

Die unter Säugetieren und Vögeln weit verbreiteten Coronaviren sind RNA-Viren und verursachen bei immungesundenMenschen in erster Linie milde Erkältungskrankheiten. Das elektronenmikroskopische Erscheinungsbild der Virusoberfläche erinnert an eine Krone (lat. »corona«). Die Fortsätze dieser Krone werden von den viralen Glykoproteinen, sog. Spikes, gebildet, die in die Virushülle eingelagert sind.
Unterschieden werden 6 humanpathogene Coronaviren, die entweder zum Genus Alpha-Coronavirus oder Beta-Coronavirus gehören (Subfamilie Coronavirinae, Familie Coronaviridae). Wenngleich meist problemlos verlaufende akute respiratorische Erkrankungen verursacht werden, kann es auch zu schweren Pneumonien kommen, vor allem bei bestehender Komorbidität oder bei Infektionen mit spezifischen humanen Beta-Coronaviren. Das neue Coronavirus SARS-CoV-2 gehört wie SARS-CoV-1, MERS-CoV (Middle East respiratory syndrome coronavirus) sowie die als „Erkältungsviren“
zirkulierenden humanen Coronaviren (HCoV) HKU1 und OC43 in die Gruppe der Beta-Coronaviren und komplettiert somit auf 7 humanpathogene Coronaviren.
Auch SARS-CoV-2 verfügt über sogenannte „Spike-Proteine“ und verwendet das Angiotensin Converting Enzym-2 (ACE-2) als Rezeptor, um in die Wirtszellen zu gelangen. Besonders betroffen sind Bereiche mit hoher ACE-2-Dichte wie der Atemwegstrakt, der Darm, Gefäßzellen, die Nieren, der Herzmuskel und andere Organe. Das virale RNA-Genom des Coronavirus infiziert die neue Wirtszelle und „weist“ die Wirtszelle an, Polyproteine für die Replikationsmaschinerie des neuen Coronavirus bereitzustellen. Das SARS-CoV-2-Genom codiert eine Papain-ähnliche Cysteinprotease (PLPro) und eine weitere 3-Chymotrypsin-ähnliche Cysteinprotease (3CLPro), die für die Replikation wichtigste Protease. Beide Enzyme sind für die proteolytische Verarbeitung der viralen Proteine während ihrer Reifung verantwortlich (Chen et al., 2020; Krichel et al. 2020).
Stadien des Lebenszyklus von SARS-CoV-2:
1. Virus-Eintritt in die Zelle
2. Translation der viralen Replikationsmaschinerie
3. Replikation
4. Translation der viralen Struktur-Proteine
5. Zusammenlagerung der Virionen (Viruspartikel)
6. Freisetzung der Viren
Abbildung 1 zeigt den SARS-CoV-2 Replikationszyklus und Inhibitoren (Pluskota-Karwatka et al. 2021; V’Kovski P, et al. 2021):

Mutationen und Virusvarianten von SARS-COV-2
Viren sind in der Lage, ihr Erbgut zu verändern und auch das Coronavirus SARS-CoV-2 kann unterschiedliche Mutanten hervorbringen. Das Virus erwirbt seit Beginn seiner Verbreitung eine zunehmende Anzahl von polymorphen Nukleotidpositionen, die zu Aminosäure-Austauschen führen. Anhand derer werden die Viren in verschiedene Varianten unterteilt. Die meisten Mutationen bleiben ohne gravierende Folgen, viele führen zu keinen Änderungen der Aminosäuresequenz (sogenannte stille Mutation). Viel seltener führen diese Veränderungen des Erregergenoms zu veränderten Virus-Eigenschaften, sodass besorgniserregende Varianten entstehen können. Dies ist dann der Fall, wenn
Virusvarianten zum Beispiel virulenter und somit ansteckender und/oder gefährlicher sind, oder, wenn das Immunsystem von bereits genesenen oder geimpften Personen diese Virusvarianten weniger gut abwehren kann. Höhere Übertragbarkeit, veränderte Immunantwort und schwererer Krankheitsverlauf bei einer SARS-CoV-2 Virusvariante führen zu deren Einstufung als „VOC“ (engl. variant of concern),
also einer besorgniserregenden Virusvariante. Varianten, die Aminosäure-Austausche im S-Protein aufweisen, wie sie auch bei VOC vorkommen, für welche aber Eigenschaften wie eine höhere Übertragbarkeit oder eine veränderte Immunantwort nicht ausreichend nachgewiesen wurden, können als „variant of interest“ (VOI) eingestuft werden und stehen unter besonderer Beobachtung (www.rki.de/Content/InfAZ/N/Neuartiges_Coronavirus; BA2.75 und 4.6).
Die WHO listet derzeit folgende VOC: https://www.who.int/en/activities/tracking-SARS-CoV-2-variants/
Omikron-Subvarianten
Am 26. November bezeichnete die WHO die Omikron-Variante des Coronavirus als eine neue besorgniserregende Variante. Die Variante wurde zuerst in Südafrika und Botswana identifiziert und ist inzwischen in mindestens 190 Ländern nachgewiesen worden. Wie in vielen Ländern entwickelte sich Anfang 2022 auch in Deutschland die Omikron Variante (B.1.1.529) rasch zur vorherrschenden Variante. Erstmals über diese Variante berichtete Ende November das südafrikanische Gesundheitsministerium. Omikron, Sublinie BA.1 wurde am 26.11.2021 von der WHO zur besorgniserregenden Virusvariante (VOC) erklärt. Im Vergleich zum ursprünglichen SARS-CoV-2 aus
Wuhan verfügt Omikron über eine außergewöhnlich hohe Anzahl von Mutationen. Es hat eine ungewöhnlich hohe Zahl von ca. 30 Aminosäureänderungen im Spike-Protein, darunter solche mit bekanntem phänotypischem Einfluss (Erhöhung der Übertragbarkeit und dem Ausweichen der (Impf-)
Immunantwort gegen den SARS-CoV-2 Wild-Typ). Phylogenetische Untersuchungen zeigen, dass Omikron unabhängig von der Delta-Variante entstanden ist. Als vorherrschende Variante in Deutschland hat Omikron andere Virus-Varianten fast vollständig verdrängt. Die Ausbreitung von Omikron erfolgt deutlich schneller als die der bisherigen Virusvarianten. Es sind inzwischen eine Vielzahl Omikron-Sublinien und weitere Einzelmutationen bekannt: Unter anderem Sublinie BA.1 und der Sublinie BA.2 entstammenden BA.2.75, BA.2.75.2, BA.3 sowie BA.4 und BA.5.
BA.1: Ursprünglich war eine als BA.1 bekannte Subvariante die am häufigsten zirkulierende Version von Omikron.
BA.2: Im April war eine genetisch unterschiedliche Subvariante, bekannt als BA.2, für mehr als die Hälfte der neuen Fälle in den Vereinigten Staaten verantwortlich und wurde zur vorherrschenden Coronavirus-Variante auf der ganzen Welt.
BA.2.12.1: Eine neuere Subvariante, bekannt als BA.2.12.1, hat sich rasch ausgebreitet und wurde Ende Mai in den Vereinigten Staaten dominant. Die Subvariante wurde zuerst im Staat New York entdeckt.
BA.4 und BA.5: Diese beiden Untervarianten von Omikron wurden erstmals im Januar und Februar identifiziert und im Mai mit einer Häufung von Fällen in Südafrika in Verbindung gebracht.
BA.5 scheint auch Menschen zu reinfizieren, die bereits COVID-19 hatten. "Dadurch kann sich der Erreger in der Bevölkerung weit verbreiten", so Dr. Shaffner (MD, Professor der Abteilung Infektiologie, Vanderbilt University School of Medicine in Nashville). Er vergleicht eine COVID-19-Reinfektion mit einer "relativ leichten Krankheit, wie eine schlimme Erkältung" für den durchschnittlichen, gesunden Menschen – aber die Symptome können von Person zu Person stark variieren, und selbst eine Reinfektion kann potenziell eine schwere Krankheit verursachen. Es ist noch nicht klar, ob sich die gesundheitlichen Probleme mit jeder COVID-Infektion einer Person verstärken, aber eine vorläufige Studie deutet darauf hin, dass Menschen, die mehr als zweimal infiziert wurden, ein erhöhtes Risiko für schwere Erkrankungen oder den Tod haben. Und jede COVID-Infektion birgt das Risiko, LONG-COVID zu entwickeln, so die CDC (Centers for Disease Control and Prevention).
Während die Omikron-Untervarianten, die die vergangenen Wellen angetrieben haben – BA.2, BA.4 und BA.5 – abklingen, erhalten die evolutionären Nachkommen dieser Linien Mutationen, die ihnen bei der Verbreitung zu helfen scheinen (https://www.nature.com/articles/d41586-022-03157-x). Die neueste Variante, die Besorgnis auslöst, ist eine neue Untervariante von Omikron namens BA.2.75.2. Sie hat bereits die Fähigkeit erlangt, sich der Immunität aktueller Impfstoffe zu entziehen und kann von vielen antiviralen Medikamenten nicht neutralisiert werden. BA.2.75.2 ist, wie die Nomenklatur vermuten lässt, aus der Untervariante BA.2.75 hervorgegangen und breitet sich schnell aus, insbesondere in Indien, obwohl BA.2.75.2 bisher nur 0,5 % der Fälle weltweit ausmacht. Da sie viele Ähnlichkeiten mit der bestehenden Untervariante aufweist, hat die Weltgesundheitsorganisation BA.2.75.2 nicht als neue Variante eingestuft, sondern als "Omikron-Subvariante, die überwacht wird", was bedeutet, dass die Gesundheitsbehörden der Verfolgung von Fällen Priorität einräumen sollten, um hoffentlich einen Anstieg der Infektionen zu verhindern. Anfang September 2022 berichteten japanische Wissenschaftler im New England Journal of Medicine, dass Bebtelovimab die Variante neutralisieren kann und einige der ersten antiviralen Therapieoptionen, die für die COVID-Behandlung entwickelt wurden – Remdesivir
und Molnupiravir sowie Nirmatrelvir; Ritonavir – ebenfalls weiterhin wirksam sind (https://time.com/6216760/ba-2-75-2-centaurus-omicron-variant-vaccine/).
COVID19
Die Erkrankung, die von SARS-CoV-2 ausgelöst wird, wird als COVID-19 (Coronavirus Disease 2019) bezeichnet (Helmholtz, HZI). Eine Infektion wird meist über Aerosole übertragen. SARS-CoV-2-haltige Partikel werden in erster Linie über den Respirationstrakt aufgenommen (RKI-Steckbrief). Man unterscheidet größere Tröpfchen und kleinere Aerosole, die über längere Zeit in der Luft schweben und sich in geschlossenen Räumen verteilen können. Abstand halten zu anderen Personen, Einhalten von Hygieneregeln, Masken und Lüften (AHA+L) vermindern das Risiko einer Übertragung dieser Partikel durch infizierte Personen (RKI-Steckbrief). Eine Übertragung durch kontaminierte Oberflächen ist insbesondere in der unmittelbaren Umgebung der infektiösen Person nicht auszuschließen, was epidemiologisch jedoch nicht sehr relevant ist (ECDC 2020; RKI-Steckbrief), da vermehrungsfähige SARS CoV-2-Viren unter Laborbedingungen auf Flächen nur einige Zeit infektiös bleiben können (Liu et al. 2021; RKI-Steckbrief). Bei positiv getesteten Personen sind die schnelle Isolierung und die Identifikation, sowie die empfehlungsgerechte frühzeitige Quarantäne enger Kontaktpersonen wirksam. (RKI-Steckbrief; https://www.rki.de/DE/Content/InfAZ/N/Neuartiges_Coronavirus/Steckbrief.html;jsessionid=8ACA760306E69BA99667A2BF4FDE1FD8. internet0).
SARS-CoV-2-Infektionen traten initial 2020 etwa gleich häufig bei Männern und Frauen auf, wobei Männer damals häufiger schwer erkrankten und, laut einer Übersichtsarbeit, doppelt so häufig wie Frauen starben (Ortolan et al. 2020; RKI-Steckbrief). Husten, Fieber, Schnupfen, sowie Geruchs- und
Geschmacksverlust sind die häufigsten Symptome (Tab. 3), wobei der Krankheitsverlauf von symptomlosen Infektionen bis hin zu schweren Pneumonien mit Lungenversagen und Tod in der Symptomatik und der Schwere sehr unterschiedlich sein kann (RKI-Steckbrief).
Krankheitsverlauf
Bei der Mehrzahl der Patienten verläuft COVID-19 mild bis moderat als ambulant behandelbarer grippaler Infekt. Bei einigen Patienten kann eine klinische Verschlechterung mit Dyspnoe und/oder Hypoxämie mit der Notwendigkeit der Krankenhausbehandlung oder sogar Intensivbehandlung, auftreten. Besonders hohes Alter, Komorbitäten (Bluthochdruck, Adipositas, Diabetes, Herz- und Lungenerkrankugen) sowie Immunsuppression sind besondere Risikofaktoren für einen schweren Verlauf. Aufgrund der mittlerweile durchgeführten COVID-19 Impfkampagnen hat sich der relative
Anteil der Patient:innen mit schweren Infektionsverläufen, mit der Notwendigkeit der Krankenhausaufnahme, sehr deutlich reduziert. Im September 2022 sind 85,4 % der erwachsenen Bevölkerung ab 18 Jahren grundimmunisiert. Darüber hinaus erhielten bisher 72,4 % dieser Altersgruppe eine erste und 11,2 % dieser Menschen eine zweite Auffrischimpfung (RKI Monatsbericht, 29.09.2022). Es zeigt sich ein Rückgang der Verweildauer in der Klinik von 18 Tagen in der ersten Pandemiewelle auf 13 Tage in der dritten Pandemiewel-le. Auffallend ist hier insbesondere das niedrigere Durchschnittsalter mit 62 Jahren. In den ersten beiden Pandemiewellen lag das Durchschnittsalter noch bei 68 beziehungsweise 70 Jahren. Mit dem geringeren Durchschnittsalter
geht auch eine geringere Häufigkeit von Komorbiditäten einher. Der Anteil der Patienten, die eine Dialyse benötigen, ging zurück. Die Krankenhaussterblichkeit sank von 22 % (1. Pandemiewelle – PW) auf 15 % (3. PW). Die Sterblich-eit bei beatmeten Intensivpatienten ist jedoch weiter hoch. Insgesamt ist aber eine deutliche Verschiebung bei den Beatmungsverfahren hin zur nicht-invasiven Beatmung zu beobachten. Im Laufe der Pandemie ist es durch die rechtzeitige Gabe von spezifischen Medikamenten gelungen, schwere Verläufe abzumildern (Karagiannidis et al. 2022).
Manifestationen, Komplikationen und Krankheitsfolgen
Abhängig von der Dichte der ACE2-Rezeptoren in den Geweben, die dem Virus den Eintritt in die Zelle ermöglichen, kann sich COVID-19 in der Lunge sowie in anderen Organsystemen manifestieren. Die histopathologische Untersuchung von Geweben von SARS-CoV-2-infizierten Patienten zeigte eine durch das Virus verursachte zytopathische Wirkung mit Anzeichen eines akuten Atemnotsyndroms in den Lungenzellen (Kumar et al. 2019). Des Weiteren werden überschießende Immunreaktionen sowie Durchblutungsstörungen in Folge einer gesteigerten Blutgerinnung (Hyperkoagulabilität) beobachtet (Sardu et al. 2020; Tang et al. 2020; RKI-Steckbrief).
Erkrankungen der Lunge
Atemwegsinfektionen, die meist in der zweiten COVID-19-Krankheitswoche auftreten, sind sehr häufig und können zu einer Pneumonie werden und schlimmstenfalls zu einem beatmungspflichtigen ARDS (Acute Respiratory Distress Syndrome) führen, was u. U. eine Sauerstoffaufsättigung des Blutes außerhalb des Körpers (ECMO) notwendig machen kann (Yang et al. 2020; RKI-Steckbrief). SARS-CoV-2 kann Lungenzellen besonders gut angreifen, weil es dort viele ACE2-Rezeptoren gibt. Der Prozess des Eindringens sowie das Vorhandensein des Virus in den Wirtszellen löst verschiedene Schutzreaktionen aus, die letztendlich die Lungenentzündung und das akute Atemnotsyndrom auslösen können. Zhou et al. berichteten über den potenziell immunpathologischen Mechanismus, durch den CD4+ T-Lymphozyten bei einer Virusinfektion aktiviert werden und zu pathogenen T-Helfer (Th) 1-Zellen werden, welche u. a. GM-CSF sekretieren. Eine große Menge Interleukin-6 wird von entzündlichen
CD14+CD16+ Monozyten ausgeschüttet, wodurch sich die Entzündung beschleunigt. Diese übermäßigen, nicht wirksamen Immunreaktionen des Wirts, die in den Lungenkreislauf gelangen, spielen eine immunologisch schädigende Rolle bei der Lungenpathologie (Zhou Y. et al. 2020).
Neurologische Symptome und Erkrankungen
Riech- und Geschmacksstörungen, Kopfschmerzen, Schwindel, Verwirrtheit und andere Beeinträchtigungen sind neurologische Symptome einer SARS-CoV-2-Infektion. Beschrieben werden weiterhin neuropsychiatrische Symptome bzw. Krankheitsbilder, SARS-CoV-2-assoziierte (Meningo-) Enzephalopathien sowie Schlaganfälle, Fälle von Guillain-Barré- und Miller-Fisher-Syndrom (RKI-Steckbrief; Woo et al. 2020).
Gastrointestinale Symptome
Übelkeit, Erbrechen, abdominelle Schmerzen, Appetitlosigkeit, Durchfälle sowie Leberfunktionsstörungen können ebenfalls im Rahmen einer SARS-CoV-2-Infektion auftreten (RKI-Steckbrief).
Leber
Wanner et al. lieferten klinische, histopathologische, molekulare und bioinformatische Beweise für den hepatischen Tropismus von SARS-CoV-2. In zwei unabhängigen Kohorten von Patienten mit COVID-19, die ins Krankenhaus eingeliefert werden mussten, wurde festgestellt, dass Leberschäden, angezeigt durch eine hohe Häufigkeit von abnormen Leberfunktionstests, ein häufiges klinisches Merkmal von COVID-19 sind. Anhand von Autopsie-Proben konnte der Lebertropismus von SARS-CoV-2 nachgewiesen werden, einschließlich des Nachweises viraler RNA in 69 % der Autopsie-Leberproben und der Isolierung von infektiösem SARS-CoV-2 aus Lebergewebe nach dem Tod (Wanner et al. 2022).
Herz-Kreislauf-Symptome und Erkrankungen
Insbesondere bei schwer verlaufenden Atemwegsinfektionen kommt es bei einigen Patienten zu kardiovaskulären Erkrankungen, einschließlich Myokardschädigungen, Myokarditis, akutem Myokardinfarkt, Herzinsuffizienz, Herzrhythmusstörungen und venösen thromboembolischen Ereignissen (Driggin et al. 2020; Long et al. 2020; RKI Steckbrief). Die pathologisch erhöhte Blutgerinnung geht bei schweren COVID-19 Verläufen mit einem erhöhten Risiko für Thromboembolien, u. a. in den unteren Extremitäten, sowie Lugenarterien- und zerebrovaskulären Embolien und daraus resultierenden möglichen Folgeschäden einher (Zou et al. 2020; Middledorp et al. 2020).
Nierenerkrankungen
Insbesondere bei Patienten mit akutem oder dialysepflichtigem Nierenversagen wurden schwere beatmungspflichtige COVID-19-Verläufe beobachtet (Yang et al. 2020; RKI-Steckbrief).
Dermatologische Manifestationen
Dermatologischen Manifestationen treten selten auf (0,2-1,2 %), können dann aber sehr unterschiedlich sein (RKI-Steckbrief). Es gibt juckende morbilliforme Ausschläge, Papeln, Rötungen und Nesselsucht-ähnliche Hautreaktionen sowie Hautbläschen und Frostbeulen-ähnliche Hautläsionen. Selten beschrieben werden auch schwere Durchblutungsstörungen in den Akren bis hin zum Gangrän (RKI-Steckbrief).
Hyperinflammationssyndrom
Etwa 8-15 Tage nach Erkrankungsbeginn kann es bei einigen Patienten mit schwerem Krankheitsverlauf zu einer Verschlechterung in Form eines Hyperinflammationssyndroms mit Multiorganversagen kommen, das mit hoher Mortalität einhergeht. (https://www.rki.de/DE/Content/InfAZ/N/Neuartiges_Coro-navirus/Steckbrief.html;jsessionid=8A-CA760306E69BA99667A2BF4FDE1FD8.)
Koinfektionen mit Pilzen und Bakterien
Bei schweren COVID-19-Verläufen mit längeren Intensivaufenthalten kann es besonders unter der angewandten Immunsuppression zu Ko-Infektionen (Yang et al. 2020; Zhou et al. 2020; Lai et al. 2020; RKI-Steckbrief) mit Pilzen wie Aspergillus spp. oder Candida albicans oder bakteriellen Infektionen durch Mycoplasma pneumoniae sowie zu Superinfektionen mit multiresistenten Bakterien (z. B. resistente Varianten von Klebsiella pneumoniae (Langford et al. 2020; RKI-Steckbrief) oder Acinetobacter baumannii (RKI-Steckbrief) kommen.
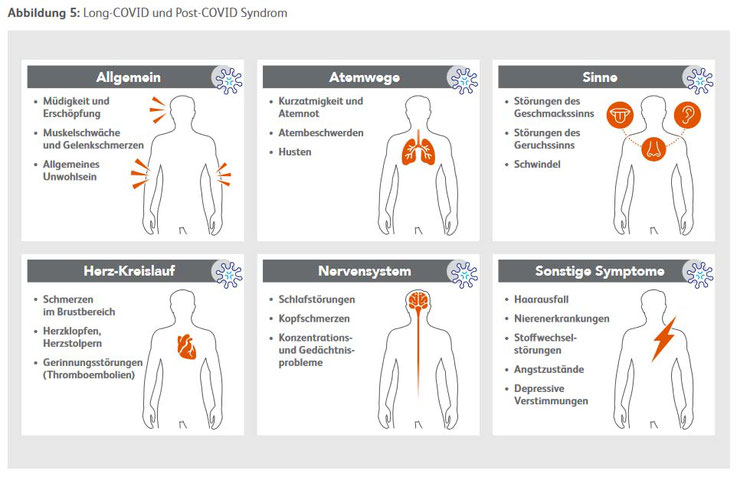
Langzeitfolgen, "Post-Covid-Syndrom", "Long-Covid-Syndrom"
Nach den ersten Leitlinienempfehlungen des britischen National Institute for Health and Care Excellence (NICE) zu Diagnostik und Therapie werden Krankheitssymptome, die über mehr als 4 Wochen seit der SARS-CoV-2-Infektion bzw. des COVID-19-Krankheitsbeginns hinaus bestehen, als „Long COVID“ bezeichnet (NICE 2020; RKI Steckbrief). Nach neueren Daten wird der Zeitraum mit 12 Wochen oder mehr angegeben. Zudem haben 16 medizinische Fachgesellschaften unter Federführung der Deutschen Gesellschaft für Pneumologie und Beatmungsmedizin e. V. (DGP) eine Leitlinie zu Long- und Post-COVID für medizinisches Fachpersonal erstellt. Anhand dessen konnte eine Patienten-Leitlinie entwickelt werden, die häufige Symptome von Long- und Post-COVID beschreibt und erklärt, wie Betroffene sich verhalten können, wenngleich vieles noch unbekannt ist (https://www.zusammengegen corona.de/covid-19/long-covid-langzeitfolgen-einer-covid-19-erkrankung/).
Nach aktuellen Leitlinien und WHO ist je nach Zeitraum, in dem die Beschwerden bestehen, die Definition wie folgt: Post-COVID-19 tritt bei Personen mit einer wahrscheinlichen oder bestätigten SARS-CoV-2-Infektion auf – in der Regel drei Monate nach der Diagnose von COVID-19 mit Symptomen, die mindestens 2 Monate andauern und nicht durch eine andere Diagnose erklärt werden können. Häufige Symptome sind Müdigkeit, Kurzatmigkeit, kognitive Funktionsstörungen, aber auch andere und haben im Allgemeinen Auswirkungen auf das tägliche Leben. Die Symptome können neu
auftreten, nachdem zunächst eine Genesung einer akuten COVID-19-Episode erfolgt ist oder seit der Ersterkrankung bestehen bleiben. Die Symptome können auch schwanken oder es kann im Laufe der Zeit Rückfälle geben (https://apps.who.int/iris/handle/10665/345824). Eine
allgemeingültige Defi-
nition für Long-COVID und Post-COVID gibt es noch nicht, denn die Spätfolgen sind komplex, in ihrer Intensität und Dauer oft sehr unterschiedlich und manchmal nur schwer von anderen Krankheitsbildern abzugrenzen (https://www.bmbf.de/bmbf/shareddocs/faq/long-covid-langzeitfolgen-forschung.html; 23.08.2022).
„Long-COVID“: mehr als vier, in anderen Untersuchungen mehr als 12, Wochen nach Infektion oder Erkrankung fortbestehende Symptome (Abb. 5)
„Post-COVID-19-Syndrom“: jenseits von zwölf Wochen noch bestehende oder neu auftretende Symptome oder Gesundheitsstörungen, die anderweitig nicht erklärt werden können (RKI Steckbrief).
Das Krankheitsbild ist uneinheitlich mit unterschiedlichsten Symptomen wie Müdigkeit, Erschöpfung, eingeschränkte Belastbarkeit, Kurzatmigkeit, Konzentrations- und Gedächtnisprobleme, Schlafstörungen, Muskelschwäche und -schmerzen sowie psychische Probleme wie depressive Symptome und Ängstlichkeit. Einschränkungen der Organfunktionen von Lunge, Leber und Nieren werden beschrieben, darüber hinaus auch Herzmuskelentzündungen und das Neuauftreten eines
Diabetes mellitus (NICE 2020; RKI-Steckbrief). Die Symptome können über Wochen und Monate andauern, nach Abklingen wieder auftreten oder neu hinzukommen (Groff et al. 2021; Michelen et al. 2021; Akbarialiabad et al. 2021;RKI-Steckbrief 87-93). Erschöpfung und eingeschränkte Belastbarkeit, Kurzatmigkeit in Ruhe und Einschränkungen von Konzentrations- und Merkfähigkeit („Brain Fog“) werden nach WHO als besondere Alltagsbeeinträchtigung bewertet (WHO 2021). Nach Schätzungen der Deutschen Gesellschaft für Pneumologie und Beatmungsmedizin (DGP) sind bis zu 15 Prozent aller Erkrankten von Long-COVID und zwei Prozent von Post-COVID betroffen (https://www.zusammen
gegen corona. de/ covid-19/long-covid-langzeitfolgen-einer-covid-19-erkrankung/ 4/11; https://www.medrxiv.org/content/10.1101/2022.08.09.22278592v1.full.pdf).
Schwere COVID19-Verläufe und Long-COVID bei ungeimpften Patienten
Patienten mit schwerem COVID-19-Verlauf sind am häufigsten von Spätfolgen betroffen. Es ist davon
auszugehen, dass bei rund 40 Prozent der Betroffenen mit schweren COVID-19-Verläufen eine längerfristige medizinische Unterstützung notwendig ist, insbesondere zur Verbesserung der eingeschränkten Lungenfunktion oder anderer beeinträchtigter Organe. Veränderungen der Lunge sind häufig noch Monate nach Beginn der Symptomatik zu erkennen. Auch Patienten mit leichtem Verlauf können unter Spätfolgen leiden.
Risikofaktoren für einen schweren Krankheitsverlauf
Viele unterschiedliche, potenziell prädisponierende Vorerkrankungen, sowie andere Einflussfaktoren machen eine Risiko-Einschätzung sehr komplex. Abbildung 6 zeigt Personengruppen, bei denen schwere Krankheitsverläufe häufiger beobachtet werden (https://www.rki.de/DE/Content/InfAZ/
N/Neuartiges_Coronavirus/Steckbrief.html;jsessionid=1EEB-C36CDDEE5212985). Das Risiko für einen schweren Verlauf
steigt ab etwa 50–60 Jahren – schwere Verläufe können jedoch auch bei jüngeren Leuten und bei Personen ohne bekannte Vorerkrankung auftreten (RKI-Steckbrief).
Dabei ist zu beachten, dass sowohl eine vollständige Impfung mit den derzeit zugelassenen COVID-19 Impfstoffen (3-fach Impfung bei Personen < 60 Jahre und ohne Vorerkrankungen, 4-fach bei Personen > 60 Jahren und mit Komobiditäten – aktualisierte Impfempfehlungen nach STIKO), als auch eine durchstandene SARS-CoV-2-Infektion das Risikofür einen schweren Verlauf bei Durchbruchinfektion oder Re-Infektion deutlich reduzieren. Trotz dessen verbleiben bestimmte Subpopulationen auch nach Impfung oder Genesung unter erhöhtem Risiko für einen schweren Verlauf, wobei ein hohes Alter stark mit dem Risiko auf Hospitalisierung und Tod assoziiert bleibt. Diese Patientengruppen sollten für weitere Booster-Impfungen und COVID-19 Therapeutika vorrangig betrachtet werden, s. hierzu auch Risk Factors for Severe COVID-19 Outcomes Among Persons Aged ≥18 Years Who Completed a Primary COVID-19 Vaccination Series —
465 Health Care Facilities, United States, December 2020–October 2021 | MMWR (cdc.gov) Evaluation of Risk Factors for Postbooster Omicron COVID-19 Deaths in
England | Infectious Diseases | JAMA Network Open | JAMA Network).
Angaben zur Hospitalisierung liefert eine Auswertung der ersten und zweiten COVID-Welle. Danach wurden 33 % der hospitalisierten COVID-19-Patienten auf der Intensivstation (ITS) behandelt, 20 % wurden beatmet (Alter im Median 73 Jahre). Der ECMO-Anteil liegt bei etwa 10 % der Beatmeten
nach Daten aus den USA. 26 % der hospitalisierten COVID-19-Patienten verstarben (Anteil bei ITS-Patienten 30 %, bei beatmeten ITS-Patienten 36 %) (Tolksdorf et al. 2020; RKI SB).
Durchbruchinfektionen und Reinfektionen
COVID-19-Impfstoffe sind hochwirksam gegen COVID-19-assoziierte Krankenhausaufenthalte und Todesfälle. Allerdings können einige geimpfte Personen COVID-19 mit schwerwiegenden Folgen entwickeln. Anhand von Daten aus 465 Einrichtungen in einer großen US-amerikanischen Gesundheitsdatenbank wurden in einer Studie die Häufigkeit und die Risikofaktoren für schwere COVID-19-Verläufe nach Abschluss einer primären COVID-19-Impfung (Primärimpfung), definiert als Erhalt von 2 Dosen eines mRNA-Impfstoffs BNT162b2 oder mRNA-1273 oder einer Einzeldosis von JNJ-78436735 ≥14 Tage vor Ausbruch der Krankheit, ausgewertet. Schwere COVID-19-Verläufe wurden definiert als Krankenhausaufenthalt mit der Diagnose eines akuten Lungenversagens, Notwendigkeit einer nicht-invasiven Beatmung (NIV) und Einweisung auf eine Intensivstation (ITS) –
einschließlich aller Personen, die eine invasive maschinelle Beatmung benötigten oder verstarben (auch Entlassung in ein Hospiz). Bei den in der Studie ausgewerteten 1.228.664 Personen, die die Erstimpfung zwischen Dezember 2020 und Oktober 2021 abgeschlossen hatten, waren schwere
COVID-19-assoziierte Folgen (0,015 %) oder Todesfälle (0,0033 %) selten. Zu den Risikofaktoren für schwerwiegende Folgen gehörten Alter ≥65 Jahre, Immunsuppression und sechs weitere Grunderkrankungen (Diabetes mellitus, chronische Nieren-, Leber-, Herz- oder Lungenerkrankung sowie chronische neurologische Erkrankungen). Alle Personen mit schwerwiegenden Folgen hatten mindestens einen Risikofaktor und 78 % der Personen, die starben, hatten mindestens vier Risikofaktoren. Geimpfte Personen, die älter oder immunsupprimiert sind oder andere Grunderkrankungen haben, sollten gezielte Maßnahmen erhalten, einschließlich der Behandlung chronischer Krankheiten, Vorsichtsmaßnahmen zur Verringerung der Exposition, zusätzliche Grund- und Auffrischungsimpfungen und eine wirksame antivirale Therapie, um das Risiko für schwerwiegende Folgen und Verläufe zuvermindern. Die Erhöhung der Durchimpfungsrate ist eine wichtige Priorität für die öffentliche Gesundheit (Yek et al. 2022).
chronische Verläube bei immunsupprimierten und B-Zell-Depletierten Patienten
Die B-Zell-depletierenden Therapien mit z. B. Rituximab nehmen für die Multiple Sklerose-Behandlung, in der Rheumatologie sowie der Hämatologie eine immer größere Rolle ein. Vor dem Hintergrund der anhaltenden COVID-19-Pandemie bestand eine Unsicherheit aufseiten der Patienten sowie der Behandleren im Umgang mit Immuntherapien z. B. zur Behandlung der Multiplen Sklerose (MS). Die
initiale Sorge vor hohen Infektionszahlen und schweren COVID-19-Krankheitsverläufen bei MS-Patienten hat sich erfreulicherweise nicht bestätigt. Das Monitoring der CD19-B-Zellen im Blut könnte hier eine zusätzliche Sicherheit im Falle einer persistierenden Depletion bieten (Pawlitzki, Meuth 2021). Bei stark immunsupprimierten und besonders B-Zelldepletierten Patienten sind allerdings in Einzelfällen protrahierte und teilweise chronische SARS-CoV-2-Infektionen dokumentiert. Wichtig erscheint es deswegen, gerade bei stark und mehrfach immunsupprimierten Patienten auf einen ausreichenden und aktualisierten Impfstatus zu achten, sowie ggf. die prophylaktische Gabe monoklonaler Antikörper in Betracht zu ziehen. Nach einer Infektion ist die rasche Vorstellung dieser Patienten und, bei Bedarf, der frühzeitige Beginn einer spezifischen antiviralen Therapie essenziell (https://www.jstage.jst.go.jp/article/internalmedicine/advpub/0/advpub_0241-22/_pdf).